PUNÇÃO DOS CISTOS DA MAMA
“Com aumento do uso de hormônios e o numero de mulheres acima do peso, os cistos mamários têm se tornando mais freqüentes.”
Saiba aqui um pouco mais sobre eles:
CONSIDERAÇÕES GERAIS
Os cistos mamários são lesões não proliferativas preenchidas por fluídos, que derivam de uma unidade lobular do ducto terminal. Haagensen estimou em cerca de 7% a probabilidade de uma mulher ocidental durante toda a sua vida apresentar um cisto palpável 1. Gateley identificou como fatores epidemiológicos relacionados à maior ocorrência de macrocistos, a nuliparidade, o nascimento do primeiro filho em idade avançada e a menopausa tardia – fatores comuns ao risco do câncer de mama 2. Os microcistos surgem como parte de um processo involutivo, considerado dentro das alterações funcionais benignas das mamas. Os macrocistos, contrariamente, muito provavelmente representam uma aberração deste processo normal de involução.
A maioria dos macrocistos se forma no lóbulo e representam a dilatação de ácidos lobulares. À medida que o epitélio lobular atrofia os ácidos coalescem, produzindo espaços cheios de líquido envoltos por tecido conjuntivo epitelizado. Com a distensão progressiva, o lóbulo torna-se obliterado e substituído pelo cisto repleto de líquido. É possível também que os cistos se formem em conseqüência de um desequilíbrio entre a secreção e a reabsorção.
A distinção entre os macrocisto e microcisto, se baseia na clínica, sendo considerado macrocisto aquele identificável na palpação. Evidentemente este critério não preenche outros dados relevantes para avaliações epidemiológicas. Dependendo da relação entre o volume mamário e o volume do cisto, este pode ser ou não palpável. Por isso, alguns autores consideram como macrocisto aquele maior que 10 mm.
Os macrocistos se correlacionam com risco relativo para câncer de mama significativamente maior do que os microcistos. Portanto, para efeitos epidemiológicos, uma lacuna deve ser preenchida quanto à denominação correta dos macrocistos, talvez incluindo dados da clínica e ecografia.
Os macrocistos têm importância pelas seguintes razões:
(1º) O temor que desperta na paciente quando palpável.
(2º) Sua associação indireta com risco elevado do câncer de mama.
(3º) À dificuldade no diagnóstico do câncer mamário inicial em programas de rastreamento mamográfico, particularmente nas pacientes portadoras de múltiplos cistos, que podem ocultar as lesões. Nesta situação muitas áreas ficam de difícil avaliação na mamografia pela sobreposição de imagens.
O mecanismo de formação do macrocisto é incerto. Como há relação entre o ciclo reprodutivo e a época de aparecimento, há evidências que fator hormonal possa desempenhar papel na sua gênese. Estudos têm demonstrado que nestas pacientes as concentrações séricas dos ácidos graxos essenciais são menores do que na população geral 3.
Apresentação Clínica e Radiológica
A maioria dos macrocistos é diagnosticada na perimenopausa. Ao exame clínico se expressa como um abaulamento, nodulação móvel, flutuante, usualmente multifocal e bilateral. A dor pode acompanhar aqueles de crescimento rápido.
Na mamografia, uma imagem nodular radiopaca de contornos regulares é o achado mais comum, sendo indistinguível de uma lesão sólida tipo fibroadenoma. Nas mamas densas, ou nos casos em que está presente um processo inflamatório crônico Peri-cístico, estes bordos podem não estar tão bem definidos. O processo inflamatório pode surgir como resposta às várias punções esvaziadoras. Uma calcificação característica em “casca de ovo”, na parede do cisto, denota evolução antiga. As calcificações semilunares, em “leite de cálcio”, são mais comuns nos pequenos cistos. Estas calcificações, na incidência crânio-caudal, preenchem de forma puntiforme toda a imagem nodular, enquanto que na incidência oblíqua ou perfil, há um depósito destas na porção inferior.
A ultra-sonografia é o exame com maior precisão diagnóstica, devendo ser preferencialmente munido de transdutor de alta freqüência (7.5 – 13 MHz). Todavia, cistos com conteúdo espesso podem confundir o ultra-sonografista na distinção de um nódulo sólido. A imagem típica é a de uma lesão nodular ou elipsóide, que sofre modificação de sua forma pela compressão do transdutor.
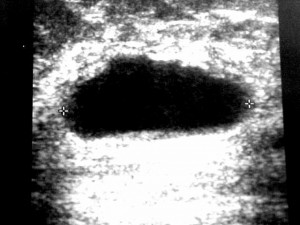
Figura 1 – Macrocisto simples – conteúdo anecóide, paredes regulares, acentuado reforço acústico posterior, elipsóide.
Os contornos são regulares e o conteúdo é anecóide, produzindo reforço acústico posterior. Algumas formas de apresentação criam dificuldades de diagnóstico. Os cistos localizados profundamente no parênquima mamário podem ter o reforço acústico não tão bem caracterizado. Os cistos submetidos a repetidas punções podem desenvolver fibrose na sua parede, imprimindo aspecto ecográfico de lesão sólida, por vezes suspeita para malignidade, com conteúdo hipoecóide e sombra acústica posterior. Nestes casos, a parede se apresenta hiperecóide, com ou sem microcalcificações na sua periferia 4.
O diagnóstico de um cisto simples na ecografia, traduzido como um nódulo radiopaco na mamografia reporta a esta paciente, na ausência de qualquer outro achado radiológico, sua inclusão na categoria II de BI-RADS (Breast Imaging Reporting and Data System). O intervalo de seguimento radiológico é aquele próprio para a faixa etária da paciente. Evidentemente, havendo punção esvaziadora, o acompanhamento ecográfico será feito num intervalo menor, visando identificar recorrências precoces.
Os cistos complexos fazem parte das alterações fibrocísticas. Podem também ser de natureza infecciosa ou abrigar uma lesão maligna ou atípica.
Os cistos complexos, com maior suspeita de malignidade, são aqueles com septos internos grosseiros, margens externas angulares, microlobulados, margem interna convexa, vegetações no seu interior, ecotextura heterogênea, falta de mobilidade e sombra acústica posterior.
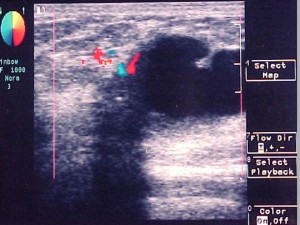
Figura 2 – Macrocisto Complexo – paredes irregulares, conteúdo anecóide, septo grosseiro, área sólida com microcalcificação na parede, color Doppler positivo, que fornece acentuada sombra acústica posterior (a biópsia excepcional revelou carcinoma lobular invasivo).
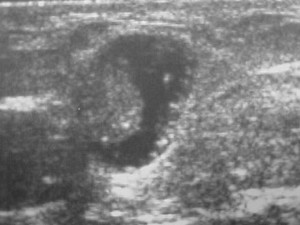
Figura 3 – Cisto complexo – lesão papilífera intra-cística (biópsia excepcional revelou um carcinoma papilífero).
As lesões suspeitas devem ser biopsiadas 5. A aspiração é normalmente não é indicada, uma vez que, se todo o conteúdo líquido for aspirado, torna difícil, a sua localização posterior para exercer cirúrgica.
O color Doppler não adiciona informações úteis que possam ajudar no diagnóstico e conduta. Não existem também dados de literatura que sustentem o uso da ressonância magnética nos macrocistos.
Distinção Estrutural e Bioquímica dos Macrocistos
O cisto mamário típico tem forma esférica e cor azulada, produzida pelo conteúdo líquido escuro, que varia do verde ao marrom, e é visto por transparência da cápsula. O revestimento interno pode ser preenchido por epitélio apócrino ou não. O estroma que envolve o cisto pode ter um componente fibroso ou estar infiltrado por linfócitos, plasmócitos e histiócitos.
Tem sido observado que os conteúdos fluídos dos cistos mostram distribuição bimodal na concentração de algumas substâncias, incluindo eletrólitos, hormônios e fatores de crescimento 6,7. Os cistos apócrinos, contrariamente aos simples, tendem a ter maior concentração de potássio, são em geral múltiplos e com tendência a recorrência após a punção esvaziadora. Altas concentrações de hormônios são encontradas em cistos apócrinos, incluindo androstenediona, epiandrostenediona, deidroepiandrosterona e estrógenos 7,8. Com base na diferença de sua composição, podem ser classificados como cistos Tipo I e II.
Cistos Tipo I:
- Epitélio apócrino.
- Composição eletrolítica similar ao fluído intracelular.
- Alta concentração de potássio com baixa de sódio.
- Alta concentração de hormônios esteróides (andrógenos e estrógenos conjugados) e de fator de crescimento epidérmico.
- Múltiplos.
Cistos Tipo II:
- Epitélio plano atenuado.
- Composição eletrolítica similar ao plasma.
- Baixa concentração de potássio em relação ao sódio.
- Baixa concentração de hormônios esteróides e do fator de crescimento epidérmico.
- Únicos.
Alguns autores descrevem os cistos tipo III, com características na suas composições intermediárias entre o I e o II 7, 9,10. Os fatores de risco histológicos têm sido reportados mais comumente com os cistos tipo I, que traduziriam atividade epitelial maior nesta mama. Lai et al. encontraram concentrações significativamente elevadas de IGFBP-3 (insulin-like growth factor-binding protein-3), IFG-I e II (growth factors I and II) e transformação destas em TGF-beta2 (growth factor-beta2) nos cistos tipo II, e procuraram justificar com isso o baixo risco de câncer de mama neste grupo de mulheres em relação àquelas possuidoras de cistos tipo II 11.
A Relação dos Macrocistos com o Câncer de Mama
Os macrocistos podem ter relação com o câncer de mama de forma direta, quando alojam uma lesão neoplásica, ou indireta como marcador de risco. Os macrocistos se associam com a involução mamária. O processo parece ser ativo e estes representam um marcador de atividade epitelial aumentada. Não são consideradas lesões pré-malignas, simplesmente marcadores de risco. A ocorrência do câncer no macrocisto é incomum, geralmente se dando naqueles complexos.
Os ensaios clínicos que calcularam o risco relativo do câncer de mama em pacientes com macrocistos calcularam este com sendo de 1.2 a 4.4. A associação com história familiar de câncer de mama pode dobrar este risco. Dupont et al., após levantamento retrospectivo de 10.366 biópsias mamárias, avaliaram as taxas de risco relativo para câncer de mama em mulheres com doença proliferativa, demonstrando ser de 1.2 para as mulheres portadoras de macrocisto, se elevando para 2.7 quando associado à história familiar positiva 12. Dixon et al. reportaram a idade como fator relacionado à magnitude do risco relativo de desenvolver câncer 9. Para as mulheres abaixo dos 45 anos o risco foi maior, de 5.94, enquanto que para aquelas acima desta idade, foi de 1.73. Os autores, todavia não encontraram diferença entre pacientes portadoras de cistos tipo I e tipo II, ao contrário do que se tem publicado em outros trabalhos semelhantes, como o de Bruzzi 6. Também não demonstraram que mulheres com múltiplos cistos são mais expostas, do que aquelas com cisto único, ao desenvolvimento do câncer de mama.
O risco do câncer de mama se eleva nas pacientes portadoras de lesões proliferativas, em particular aquelas atípicas. O modelo de Gail é uma fórmula matemática que cálcula o risco absoluto de desenvolvimento do câncer de mama durante a vida, tendo como uma das variáveis a história pregressa de biópsia mamária. Considerando a punção dos macrocistos, como uma forma de biópsia acreditou que deva ser incluído no cálculo de risco de Gail 13.
Conduta
Nos cistos palpáveis realizamos sempre a punção aspirativa esvaziadora com agulha fina. O produto da aspiração pode ter diversas cores, que depende do tempo de existência deste cisto. A evidência de fluído hemático, descartado o acidente de punção, serve para orientar a conduta seguinte, a exerce cirúrgica.
A punção pode ser feita pela palpação, apreendendo o cisto com uma das mãos, enquanto a outra insere o sistema agulha-seringa. A preferência, entretanto, deve ser feita pela punção sob visão ecográfica.
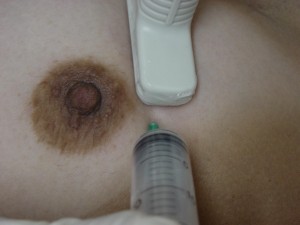
Figura 4 – Punção guiada por ultra-som. A inserção da agulha deve ser feita na margem lateral do transdutor, em ângulo de 45º.
Isto permite visualizar o conteúdo sendo esvaziado. O fluído aspirado deve ser enviado para análise, fixado com o mesmo volume de álcool etílico a 70%, para citologia oncótica. O estudo citológico desta fluído é motivo de diversas discussões acadêmicas. Stavros orienta que, não havendo qualquer sinal ecográfico de suspeita para malignidade, e não sendo hemorrágico, o fluído podem ser desprezados 5. Smith et al. avaliaram a utilidade desta análise citológica nos cistos impalpáveis. Os autores acompanharam prospectivamente por cerca de 42 meses, 583 mulheres submetidas à aspiração de 660 cistos. Em 5% (n=33) das lesões encontraram-se células atípicas. Todas eram malignas 16. O custo da análise citológica diante da freqüência de material acelular continua sendo a principal razão das discussões.
Após a punção o controle clínico e ultra-sonográfico devem ser feitos no intervalo de cerca de um mês. A presença de imagem de massa residual, ou a recorrência em volume maior ou igual, torna prudente a completa retirada cirúrgica do cisto. Hamed et al. seguiram 401 mulheres que se apresentaram com cistos palpáveis. No primeiro retorno pós-punção, 6 pacientes tiveram seus cistos biopsiados por massa residual ou presença de hemácias visualizadas no exame citológico do produto de aspiração. Destas, 2 tinham câncer. Um retorno seguinte foi feito durante o primeiro ano e outras 20 biópsias foram realizadas. Foi feito então o diagnóstico de câncer em mais duas pacientes. O diagnóstico histológico foi de carcinoma intracístico, tumor fillodes maligno e carcinoma ductal invasivo (n=2) 17.
A distinção entre cistos Tipo I e Tipo II, através do estudo rotineiro do perfil eletrolítico do líquido aspirado, não acrescentam dados suficientes para mudar o seguimento ou conduta dos cistos Tipo I.
Os cistos complexos, com sinais ecográficos suspeitos de malignidade, têm indicação de exérese cirúrgica. A punção esvaziadora e mesmo a “core biopsy” de áreas sólidas intracísticas pode prejudicar o parâmetro clínico e ultra-sonográfico para futura localização cirúrgica.
Apesar dos macrocistos aumentarem o risco relativo para câncer de mama, não existem dados suficientes para modificarem o intervalo de rastreamento mamográfico nestas pacientes.
Em relação às pacientes com macrocistos múltiplos, bilaterais, que sofrem repetidas punções esvaziadoras a curtos intervalos de tempo, e produz dificuldade de interpretação mamográfica na detecção precoce de lesões suspeitas, a adenomastectomia profilática pode ser considerada, particularmente se houver história familiar de câncer de mama. Os argumentos contrários são relacionados à morbidade de tal conduta. Em 1993, a Society of Surgical Oncology expôs parecer acerca das indicações para a adenomastectomia profilática, tendo incluído as pacientes sem câncer mamário prévio com história familiar de câncer de mama bilateral em um parente de primeiro grau na pré-menopausa, e aquelas mulheres com mamas fibronodulares densa com antecedente familiar positivo para câncer 18. Os dados e os números relativos aos riscos devem ser apresentados e discutidos com a paciente, para que esta faça sua decisão consciente.
Autores:
Marcos Desidério Ricci
Marcelo Gennari
Marianne Pinotti
REFERÊNCIAS Bibliográficas
- Haagensen CD, Bodian C, Haagensen DE, Jr. Breast cancer risk and detection. Philadelphia: WB Saunders, 1981:70-5.
- Gateley CA, Bundred NJ, West RR, Mansel RE. A case control study of factors associated with macroscopic breast cysts. Eur J Cancer;28(1):125-7, 1992.
- Mannello F, Bocchiotti GD, Morano FP, Fratepietro LM, Gazzanelli G. Lipids status in human breast cyst fluids. Cancer Lett ;98(2):137-43, 1996.
- Rocha DC, Bauab SP. Atlas de imagem da mama: correlação entre mamografia e ultra-sonografia. São Paulo: Sarvier, 1995.
- Stavros T. Sonographic Evaluation of Cystic Structures in the Breast. Colorado:W.B. Saunders; 245-61, 1999.
- Bruzzi P, Dogliotti L, Naldoni C, Bucchi L, Costantini M, Cicognani A, Torta M, Buzzi GF, Angeli A .Cohort study of association of risk of breast cancer with cyst type in women with gross cystic disease of the breast. BMJ; 314(7085): 925-8, 1997.
- Vizoso F, Fueyo A, Allende MT, Fernandez J, Garcia-Moran M, Ruibal A .Evaluation of human breast cysts according to their biochemical and hormonal composition, and cytologic examination. Eur J Surg Oncol Jun; 16(3):209-14, 1990.
- Grosso A, Gardelli G, Mei F, Battista G, Boriani F, Ghigi G, Motta R, Marino AS, Burlizzi S, Corinaldesi A. The correlation between morphology, electroytic content and risk factors in breast cysts. Radiol Med Mar; 91(3):194-7, 1996.
- Dixon JM, McDonald C, Elton RA, Miller WR. Risk of breast cancer in women with palpable breast cysts: a prospective study. Edinburgh Breast Group. Lancet ;353(9166):1742-5, 1999.
- Malatesta M, Mannello F, Sebastiani M, Cardinali A, Marcheggiani F, Reno F, Gazzanelli G. Ultrastructural characterization na biochemical profile of human gross cystic breast disease. Breast Cancer Res Treat; 48(3): 211-9, 1998.
- Lai LC, Erbas H, Meadows KA, Lennard TW, Holly JM. Insulin-like growth factor binding protein-3 in breast cyst fluid : relationships with insulin-like growth factors I and II and transforming growth factor-beta 1 and 2. Cancer Lett; 110 (1-2): 207-12, 1996.
- Dupont WD, Page DL. Risk factors for breast cancer in women with proliferative breast disease. N England J Med;17(1):146-51, 1985.
- Ciatto S, Biggeri A, Rosselli Deç Turco M, Bartoli D, Iossa A Risk of breast cancer subsequent to proven gross cystic disease. Eur J Cancer; 26(5):555-7, 1990.
- Bundred NJ, West RR, O’Dowd J, Mansel RE. Is there na increased risk of breast cancer in women who have had a breast cyst aspirated ? Br J Cancer; 64:953-55, 1991.
- Devitt JE, To T, Miller AB. Risk of breast cancer in women with breast cysts. CMAJ;147(1):45-9, 1992.
- Smith DN, Kaelin CM, Korbin CD, Ko W, Meyer JE, Carter GR. Impalpable breast cysts : utility of cytologic examination of fluid obrained with radiologically guided aspiration. Radiology;204(1):149-51, 1997.
- Hamed H, Coady A, Chaudary MA, Fentimans IS. Follow-up of patients with aspirated breast cysts is necessary. Arch Surg;124(2):253-5, 1989
- Society of Surgical Oncology : SSO develops position statement on prophylactic mastectomies. SSO News 1:10, 1993.


